식약처, 코로나19 치료제·백신 심사 상황 공개
코로나19 치료제와 백신의 국내 사용을 위한 식약처의 심사가 시작됐다.
11일 식품의약품안전처는 코로나19 치료제인 셀트리온 ‘렉키로나주’와 한국아스트라제네카의 백신 사용허가를 위한 접수를 받고 심사에 들어간 사실을 밝혔다.
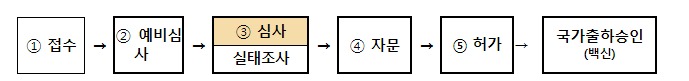
심사를 위한 주요 제출자료는 사람에게 투여했을 때 안정성과 효과를 보여주는 ‘임상시험자료’와 임상시험에 사용된 의약품이 시판 후에도 동등한 품질로 생산관리될 수 있는지 보여주는 ‘품질자료’로 나눌 수 있다.
아스트라제네카의 백신에 대한 심사 자료는 비임상시험, 임상시험, 품질, 위해성관리계획 등이 있다.
비임상시험은 동물실험을 통해 독성과 효과를 검증한 자료로, 비임상시험관리기준 및 의약품의 독성시험기준에 따라 심사한다. 이는 한국아스트라제네카의 사전검토 요청으로 1차 검토된 바 있다. 신청 용법·용량에 관한 근거가 되는 임상 2·3상 및 3상은 영국과 브라질에서 수행된 것을 바탕으로 접종 후 예방효과 등을 검토한다. 안정성은 영국(2건), 브라질, 남아프리카공화국에서 접종된 4건의 임상대상자의 결과를 통합해 평가할 계획이다.
식약처는 임상결과를 바탕으로 허가 신청 된 제품의 효과를 심사하는 동시에 비임상시험과 임상시험 중 발생한 이상사례를 면밀히 검토하고 있다. 특히 65세 이상 고령자에 대한 효과와 안정성은 별도 분석할 예정이다.
또 셀트리온의 코로나19 치료제 렉키로나주에 대한 본격적인 자료 심사와 실태조사에도 착수했다.
식약처 관계자는 “앞으로도 개발되는 코로나19 치료제와 백신의 안정성과 효과를 철저히 검증하는 동시에 최대한 신속한 심사를 위해 최선을 다하겠다”고 밝혔다.
<저작권자 ⓒ 한국건강신문, 무단 전재 및 재배포 금지>
- 이정희 기자
[email protected] - 다른기사보기